郑大三附院伦理审查流程指南(试行)2024.07
郑州大学第三附属医院 河南省妇幼保健院
伦理审查流程指南(试行)
按照国家卫生健康委《涉及人的生命科学和医学研究伦理审查办法》(国卫科教发〔2023〕4号)、《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》(国卫科教函〔2021〕155号)、《科技伦理审查办法(试行)》(国科发监〔2023〕167号)、《中华人民共和国实验动物管理条例》(2021年)以及《关于善待实验动物的指导性意见》(国科发财字〔2006〕398号),所有在我院内实施的涉及人或实验动物的生命科学或医学研究项目,应根据本指南向伦理委员会提交伦理审查申请/报告。未获得伦理委员会审查批准开展项目,研究者/医务人员不得擅自开展项目工作。
一、适用范围
目前,应当依据本指南提交伦理审查申请的研究项目,包括:
1、采用物理学、化学、生物学、中医药学等方法对人的生殖、生长、发育、衰老等进行研究的活动;
2、采用物理学、化学、生物学、中医药学、心理学等方法对人的生理、心理行为、病理现象、疾病病因和发病机制,以及疾病的预防、诊断、治疗和康复等进行研究的活动;
3、采用医疗新技术或者医疗新产品在人体上进行试验研究的活动;
4、采用流行病学、社会学、心理学等方法收集、记录、使用、报告或者储存有关人的涉及生命科学和医学问题的生物样本、信息数据(包括健康记录、行为等)等科学研究资料的活动;
5、涉及实验动物的研究项目。
经伦理委员会批准的研究项目,研究项目负责人应当按照国家有关法律法规要求将研究项目在国家医学研究登记备案信息系统进行登记备案、更新信息。
二、内容
1、伦理审查申请的类别:包括初始审查、申报前审查、跟踪审查、复审四种。
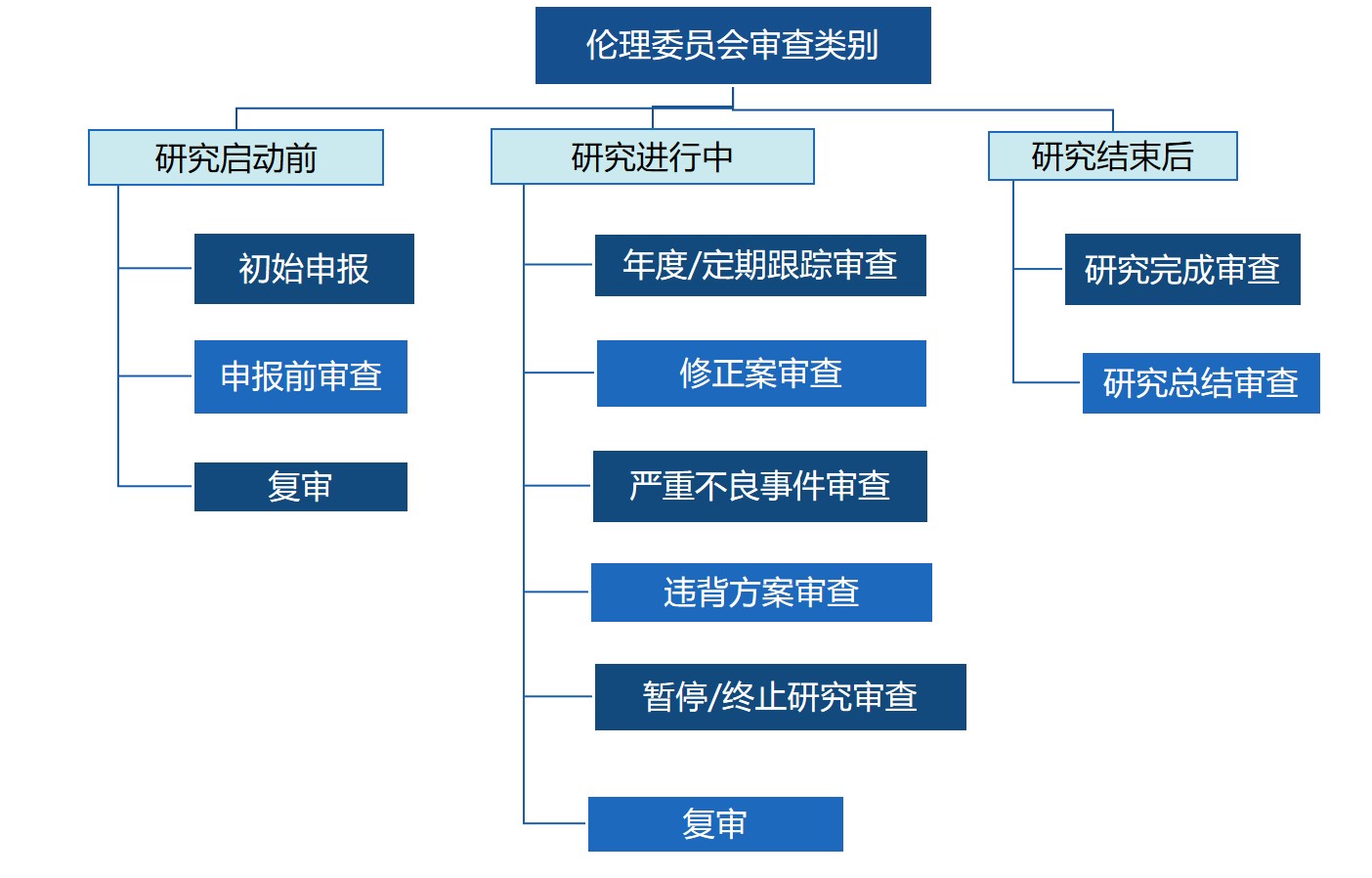
图 1 郑大三附院伦理审查申请的类别
1.1 初始审查:是指首次向伦理委员会提交的审查申请。凡是我院研究者承担与实施的涉及人或实验动物的科学研究项目,均应在研究开始前提交伦理审查申请,经批准后方可实施。
具体流程:在项目开展之前,项目负责人需要登录伦理系统平台(http://39点98点32点69:99/zdfsirb/),提交“初始审查申请”。该类型审查批件用于该项目产生的文章发表、该项目的成果申报、毕业论文的提交。批件直接下发于项目负责人。
1.2 申报前审查:准备向省卫建委、省科技厅、省教育厅、国家自然科学基金委进行省级、国家级项目申报的纵向或横向课题,项目负责人需登录伦理系统平台,提交“申报前审查申请”。注:该类型仅出具审查意见,且该审查意见仅用于申报工作。请在项目正式获批后一月内,正式开展前,及时提交正式伦理审查---“初始审查申请”。
1.3 跟踪审查:伦理委员会对所有批准的研究项目进行跟踪审查,从做出伦理审查决定开始直到研究终止。跟踪审查的形式包括年度/定期跟踪审查、修正案审查、严重不良事件审查、违背方案审查以及暂停/终止研究审查、研究完成/总结审查。
1.3.1 年度/定期跟踪审查:
(1)按照伦理审查批件规定的年度/定期跟踪审查频率,在截止日期前1个月提交年度/定期跟踪审查申请。
(2)申请人应向组长单位伦理委员会提交各中心研究进展的汇总报告。
(3)当出现任何可能显著影响研究进行、影响研究风险/受益比、或增加受试者危险的情况时,应以“年度/定期跟踪审查申请”的方式,及时报告伦理委员会。
(4)伦理审查批件超过有效期,需要申请延长批件有效期,应以“年度/定期跟踪审查申请”的方式申请延长批件有效期。
具体流程:项目负责人接到通知后(在截止日期前1个月内),需要登录伦理系统平台,提交“研究进展报告”。该类型审查意见仅用于留档备存,直接下发于项目负责人。
1.3.2 修正案审查:
(1)研究过程中做出任何修改,如若变更主要研究者、方案、知情同意书、招募材料等文件的修改,请在系统中提交修正案审查申请,批准后方可执行。
(2)特殊情况:为避免研究对受试者的即刻危险,研究者可在伦理委员会批准前修改研究方案,事后应将需改研究方案的的情况或原因,以“修正案审查申请”方式及时提交伦理委员会审查。
1.3.3 严重不良事件审查:研究者应在获知的24小时内提交报告表至伦理委员会。研究者应当按照要求和时限报告药物不良反应。研究者应当将可疑且非预期严重不良反应快速报告给伦理委员会。请在系统中提交修正案审查申请。
1.3.4 违背方案审查:重大及持续方案违背、可能对受试者安全和权益,或者对临床试验数据可靠性产生重大影响的严重违背,请研究者/申办者及时提交违背方案报告。申办者应当及时进行根本原因分析,采取适当的纠正和预防措施。请在系统中提交修正案审查申请。
1.3.5 暂停/终止研究审查:研究者暂停/或提前终止研究,应及时在伦理系统中向医学伦理委员会提交暂停/终止研究报告。报告时限20个工作日内。
1.3.6 研究完成/总结审查:对研究项目完成报告或研究总结报告的审查。研究者应当及时向伦理委员会提交研究完成报告。具体流程:项目结束前,项目负责人需要登录伦理系统平台,提交“研究完成报告”。该类型审查意见仅用于留档备存,直接下发于项目负责人。
1.4 复审
(1)复审申请:是指在初始审查和跟踪审查后,按照伦理审查意见“修改后批准”、“修改后再审”,研究者对研究方案进行修改后,应以“复审申请”的方式再次送审,经伦理委员会批准后方可实施。
(2)如果研究者对伦理审查意见有不同的看法,可以“复审申请”的方式申诉,请伦理委员会重新复核决定意见。
1.5 特殊情况伦理报告:研究过程中以下情况,研究者应及时报告伦理。
(1)临床试验实施中为消除对受试者紧急危害的试验方案的偏离或者修改;
(2)增加受试者风险或者显著影响临床试验实施的改变;
(3)所有可疑且非预期严重不良反应;
(4)可能对受试者的安全或者临床试验的实施产生不利影响的新信息。
2、提交伦理审查的流程:
2.1 提交送审文件:
2.1.1 送审责任人:研究项目的负责人;研究生课题的应由其导师或者指导教师共同签署。
2.1.2 准备送审文件:根据伦理审查申请类别的送审文件清单、研究类型,准备送审文件,方案和知情同意书等相关文件应注明版本号和版本日期。知情同意书属于使用本系统中模板格式。
(1)“申报前审查申请”的项目需要提交:受理通知(受理后系统自动生成)、申报前审查申请、课题标书、知情同意书或者免知情同意申请(伦理系统有模板)、研究者履历(伦理系统有模板)。若涉及实验动物研究的科研项目需提交实验动物福利审查表(伦理系统有模板)。
(2)“初始审查申请”的项目需要提交:受理通知(受理后系统自动生成))、初始审查申请、研究方案(伦理系统有模板)、知情同意书或者免知情同意申请或者免除伦理审查申请(伦理系统有模板)、研究者履历(伦理系统有模板)、其他(样本外送承诺书、样本检测合同、样本转移合作协议、药品说明书、指南、共识类、我院药学部的超说明书用药备案表)。
2.1.3 提交送审文件:项目负责人需要登录伦理系统平台,在系统中根据申请类别填写申请表,并提交文件。
2.2 送审文件形式审查结果通知:
(1)补充/修改送审材料通知:伦理委员会办公室受理后,如果认为送审文件不完整,文件要素有缺陷,将以短信形式通知项目负责人补充材料,并在系统中再次提交。
(2)受理通知:如果送审文件的完整性和要素通过形式审查,伦理办公室将以短信形式通知受理成功,请研究者在3个工作日内将受理通知下载打印并签字后上交于南院区28号科研楼411办公室(备注:采用无纸化办公,其他纸质材料不用再上交)。
3 伦理审查
3.1 伦理审查方式
3.1.1 会议审查:所有类别的伦理审查申请/报告
线上会议审查:所有申请文件提前分发委员审查,申请文件需经会议讨论经参会委员投票后,经意见汇总决定审查意见。
线下会议审查:对于需要线下汇报讨论的初始审查研究项目,或修改后重审项目,研究者需要进行现场汇报,并回答委员的相关问题。经参会委员投票后,经意见汇总决定审查意见。
3.1.2 快速审查:
(1)科研项目预申报:由于申报批准后还需要伦理委员会对立项再进行审查,故对项目申报一般采用快速审查方式。
(2)临床科研项目:研究风险不大于最小风险的,不涉及弱势群体、个人隐私及敏感性问题,且研究步骤仅限于:
a.通过手指、脚后跟、耳垂采集用于研究的血样;
b.静脉采集在考虑年龄、体重、健康状况、采血程序、采血总量和采血频率等因素后,判断为不大于最小风险;
c.通过无创手段、前瞻性采集用于研究的生物学标本,如头发、指甲、唾液、痰液等;
d.通过临床实践常规的非侵入性手段采集用于研究的数据,不涉及全麻、镇静、x线或微波的手段;如果使用医疗器械,必须是经过批准上市的医疗器械,如磁共振成像,心电图、脑电图、温度计、超声、红外诊断成像、多普勒血液流变、超声心动图等;
e.研究利用既往收集的材料(数据、文件、记录或标本);
f.因研究目的而进行的声音、视频、数字或者影响记录的数据采集;
g.采用调查、访谈方法的研究。
(3)伦理审查意见为“必要的修改后同意”,修改后再次送审的项目;
(4)方案修改:临床研究方案的较小修改,不影响研究的风险受益比,如错别字的修改;涉及研究后勤和行政管理方面的修改;增加研究者等;
(5)已批准研究的跟踪审查;
(6)多机构开展的研究中,参与机构的伦理审查委员会对牵头机构出具伦理审查意见的确认等;
(7)免除伦理审查申请,复核免除审查标准的,如对于既往存档的数据、文件、记录、病理标本或诊断标本的收集或研究,并且这些资源是公共资源,或者研究者是以无法联系受试者的方式(直接联系或通过标识符)记录信息的,详见本指南附件一。注:免除伦理审查还需要提交免除伦理审查申请表(系统有模板)。
3.1.3 快审转会审
快速审查过程中,出现研究的风险受益比变化、审查委员之间意见不一致、审查委员提出需要会议审查等情形的,应调整为会议审查。
3.2 伦理审查意见
(1)同意
(2)必要的修改后同意
(3)必要的修改后重审
(4)暂停/终止已批准的研究
(5)不同意
3.3 审查时限
(1)每月1日-10日为伦理审查集中接收受理时间;
(2)伦理委员会办公室受理伦理审查申请/报告后,一般需要一周时间进行处理,材料齐全的初始审查项目将提交线上会议审查。需要现场汇报讨论的初始审查项目与审查意见为“修改后会审”的项目将组织召开线下会议审查。
(3)线上会议时间:拟定每月1-2次,可根据审查项目的数量增减审查会议次数。
线下会议时间:拟定每月一次或2月一次,可根据审查项目的数量增减审查会议次数。
(4)伦理委员会根据送审项目安排审查会议,一般在受理后不超过4周进行会议审查。非预期严重不良反应等情况及时召开紧急会议审查。
(5)适用于快速审查的研究项目,每月将不定期根据需求受理。
(6)“申报前审查申请”的项目上传资料、完成提交时间,按照科研部发布的工作安排进行。
3.4 接受线下会议审查的准备:
(1)会议时间、地点:伦理委员会办公室会通过微信或短信形式通知到项目负责人会议时间及地点。
(2)项目负责人应准备好报告内容,并到会报告,提前15分钟到达会场,报告一般为5分钟左右。
(3)项目负责人因事不能到会报告,应提前3个工作日向伦理委员会办公室请假,该项目转入下次线下会议审查。
3.5 审查决定的传达:
(1)适用于会议审查的研究项目,伦理委员会办公室在伦理审查决定做出后一般不超过15个工作日内或按照有关规定时限,以“伦理审查同意函”或“伦理审查意见”的书面方式传达审查决定。
(2)适用于快速审查的研究项目,每月将不定期根据需求受理。伦理委员会办公室一般在伦理审查决定做出后10个工作日内下发“伦理审查同意函”或“伦理审查意见”的审查决定。
(3)“申报前审查申请”的项目仅出具审查意见,且该审查意见仅用于申报工作。该意见不再统一下发给个人,申办方和研究者及相关人员可以根据需求在系统下载意见函/同意函,并联系伦理委员会盖章。另外,研究者需在项目正式获批后一月内,正式开展前,及时提交正式伦理审查---“初始审查申请”。
(4)如果审查意见为肯定性决定(同意继续研究,或不需要采取进一步的措施),并且审查类别属于可疑且非预期不良反应/严重不良事件报告,违背方案审查,暂停/终止研究审查,研究完成审查,以及上述审查类别审查后的复审,伦理委员会的决定可以不传达。申办方和研究者及相关人员可以根据需求在系统下载意见函/同意函,并联系伦理委员会盖章。
4. 联系方式
伦理办公室秘书:李兵兵
电话:0371-66903974
下载资料邮箱:zdsfyll1@163.com
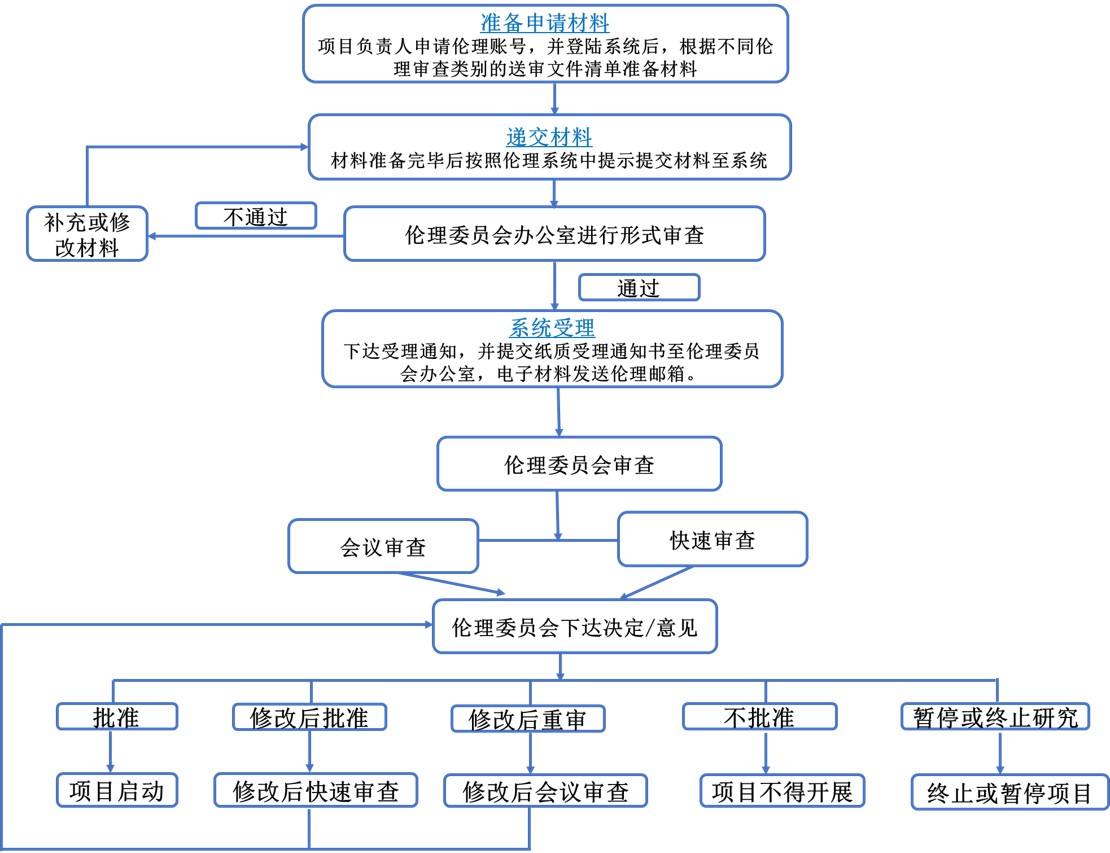
图2 郑州大学第三附属医院伦理审查流程示意图
附件一:免除伦理情况
1、免除伦理,仍需要申请伦理,可以走快速审查。
2、符合以下情况的生物医学研究项目可以申请免除审查:
(1)在正常的教育、培训环境下开展的研究,如:①对常规和特殊教学方法的研究;②教学方法、课程或课堂管理的效果研究,③不同的教学方法、课程或课堂管理的对比研究;
(2)调查研究:①教育、培训测试(认知、判断、态度、成效);②访谈调查、公共行为的观察。
(3)既往资料研究:收集研究已经有的数据、记录、废弃的病理标本/检查标本,并且这些资源是公共资源,或者由研究者保存的信息不会识别受试者,也不会直接或间接地识别受试者。
3、以下情况不能免除审查:①以直接或通过标识符的方式记录受试者信息,可以追踪到受试者;②在研究以外公开受试者信息可能会让受试者承担刑事或民事责任的风险,或损害受试者的经济、就业或名誉。
4、“涉及访谈调查,公共行为观察的研究”的免除审查一般不适用于儿童与未成年人,除非研究者不参与被视察的公共行为。
5、特殊受试人群免除审查的规定:免除审查不适用于涉及孕妇、胎儿、新生儿、试管婴儿、精神障碍人员和服刑劳教人员的研究。
6、研究者不能自行做出“免除伦理审查”的判断,应向伦理委员会提交免除审查申请,与研究方案等相关材料,由伦理委员会主任委员或授权者审核确定。
7、伦理委员会保留对符合免除审查条件的研究项目实施审查的权利。
附件二:免除知情同意情况
1、调查和观察性研究,以及利用既往临床诊疗中获得的医疗记录和生物学标本的研究,并且符合以下全部条件,可以申请免除知情同意:
(1)研究目的是重要的;
(2)研究对受试者的风险不大于最小风险;
(3)免除知情同意不会对受试者的权利和健康产生不利的影响;
(4)受试者的隐私和个人身份信息的保密得到保证;
(5)若规定需获取知情同意,研究将无法进行(病人/受试者拒绝或不同意参加研究,不是研究无法实施、免除知情同意的理由);
(6)只要有可能,应在研究后的适当时候向受试者提供适当的有关信息。
2、利用既往研究中获得的医疗记录和生物学标本的研究(研究病历/生物标本的二次利用),并且符合以下全部条件,可以申请免除知情同意:
(1)既往研究已获得受试者的书面同意,允许其他的研究项目使用其病历或标本;
(2)本次研究符合原知情同意的许可条件;
(3)受试者的隐私和个人身份信息的保密得到保证。
附件三:免除知情同意书签字
以下两种情况可以申请免除知情同意签字:
1. 当一份签了字的知情同意书会对受试者的隐私构成不正当的威胁,联系受试者真实身份和研究的唯一记录是知情同意文件,并且主要风险就来自于受试者身份或个人隐私的泄露。在这种情况下,应该遵循每一位受试者本人的意愿是否签署书面知情同意文件;
2. 研究对受试者的风险不大于最小风险,并且如果脱离“研究”背景,相同情况下的 行为或程序不要求签署书面知情同意。例如:访谈研究,邮件/电话调查。对于批准免除签署书面知情同意文件的研究项目,伦理委员会可以要求研究者向受试者 提供书面告知信息。













